“三维(3D)打印”(3D printing)的学术名称为“快速成形技术”,诞生于20世纪80年代后期,是基于材料堆积方法的一种制造技术。3D 打印的基本原理简单来说就是它利用重建的三维数字模型,将其分割成层状然后逐层堆积成实体模型。
《增材制造产业发展行动计划(2017-2020)》中提到,全球范围内新一轮科技革命与产业革命正在萌发,世界各国纷纷将增材制造作为未来产业发展新增长点,推动增材制造技术与信息网络技术、新材料技术、新设计理念的加速融合。
行动计划确定了四大领域成为应用重点:重点制造(航空、航天、船舶、核工业、汽车、电力装备、轨道交通装备、家电、模具、铸造等)、医疗、文化以及教育。
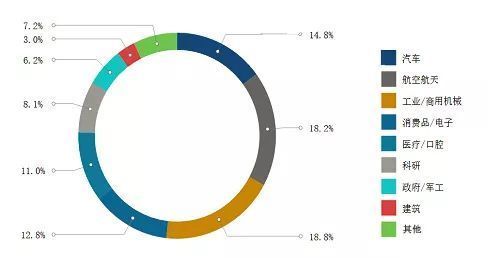
图 3D打印各行业市场份额 图片来源:网络
医疗3D打印在3D打印的各行业应用中所占市场份额达到12.8%,仅次于航空航天、汽车和机械行业,位居第四。
2016年,全球3D打印医疗市场规模达到12.29亿美元,其中3D打印植入物市场规模达到8.23亿美元,预计到2024年3D打印医疗市场规模将达到96.39亿美元,其中植入物市场达到81.2亿美元。
图片来源网络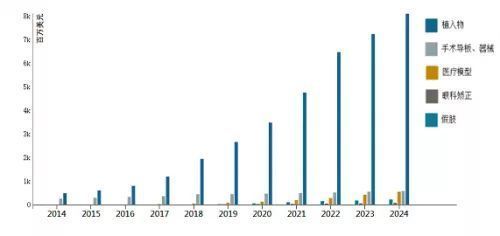
一、医疗行业用途
一是3D打印模型,用于医学教学、病例讨论等;
二是3D打印医疗器材,比如假肢;
三是3D打印用于组织功能产品,比如下颌骨、器官支架、颅骨,这些都已经进入临床,主要的功能为发挥一个支架的作用;
第四方面主要是3D 打印体组织和器官。

二、面临的挑战
尽管3d打印技术已经趋近成熟,但其商业化才刚刚启动并面临诸多挑战。
1、原材料问题
3d打印的原材料较为特殊,必须能够液化、丝化、粉末化,打印后又能重新结合起来。对金属粉末而言,材料的粒度分布、松装密度、氧含量、流动性等性能的要求会更高;对活体器官而言,如何维持细胞的活性及其功能尤为重要。特别是对于医疗器械专用材料,大多需要进行严格的生物学评价,以防止各类生物性风险的发生。
“材料研制难度大、评价周期长,它既是医学3d打印技术开发的难点也是核心。”一位来自企业界的人士表示,金属粉末原料如钛合金和高温合金,高规格的原料基本只能依靠进口解决,价格高、周期长。这些均在客观上制约了3d打印技术在国内的推广进程。
2、设备高成本、维护高费用
3D打印设备要获得引进医院的资质,一在产品精度上要有所保障,二是需要经历繁琐的审核流程。医疗领域容不得一丝差错,而目前3D打印技术的成熟度还不够完善,精细度能达到手术级别的3D打印厂商更是少之又少。
目前用于医疗器械研发的3D打印设备仍以国外为主,在3D打印机开发初期生产商就开始在原材料层面设置壁垒,目前高品质的3D打印材料仍以进口为主,由设备厂家直接供应,尚未形成成熟的第三方供应模式,这一模式将从另一侧面进一步推高原材料价格,从而造成3D打印医疗器械研发成本进一步提高。
3、缺乏行业标准
根据2018年第6号中国国家标准公告,由国家增材制造产品质量监督检验中心(江苏)牵头制定的《增材制造 主要特性和测试方法 零件和粉末原材料》现已正式发布。将于2019年3月1日起正式实施。
该标准于2015年正式立项,项目编号为20151395-T-604。由中国机械工业联合会提出,由全国增材制造标准化技术委员会(SAC/TC 562)归口。该标准为目前国内唯一一份增材制造类零件与粉末原材料主要特性及测试方法国家标准,给出了相应的推荐测试目录、测试方法及测试报告,适用于指导原材料供应商、设备制造商、设备使用者、零件供应商、客户等对通过增材制造工艺制备的零件及原材料的主要特性及测试方法进行协商。
然而,3D打印医用材料由于和传统材料不同,材料的内部结构和力学性能也不同,因此,现行标准并不适用于这类材料,需要进行研究并制定相应的标准。
4、缺乏相适应的监管模式
另外,传统的监管模式是否能够适应这种高效、特异性差别极大的3d打印医疗器械,也需要进行验证。与此同时,由于3d打印医疗器械综合了从临床诊断到材料加工及手术治疗的整个过程,如何安全有效地跟踪并监管全过程也需要相关部门进行调整适应。
据了解,国家食品药品监督管理总局(CFDA)也把3D打印医疗器械的监管提上了日程,在新的《医疗器械注册管理办法》中明确规定,3D打印医疗器械的临床研究必须报CFDA审批后才能进行。
5、3D打印厂商与医院未形成联动
对3D打印的手术方案研发仅停留于单个科室的“单打独斗”,未能形成良性循环。目前对3D打印的手术培训还比较少,要得到大规模的传播和应用,离不开医生的专业教学,现在医院的3D打印技术还处于一种早期探讨的状态。富有经验的医生已经形成了自己的手术习惯,要让他们接受相关的3D打印技术相对难度较大,而相对更有挑战和创新精神的年轻人则尚不具备主刀的尝试能力,这也给3D打印相关技术的推广带来困难。
三、准入政策
目前我国共有四款产品通过了CFDA认证,分别是:爱康医疗与北医三院合作的3D打印髋臼杯、3D打印人工椎体、3D打印脊柱椎间融合器;迈普医学3D打印硬脑(脊)膜补片。
2018年2月,国家食品药品监督总局医疗器械技术评审中心公开征求《定制式增材制造医疗器械注册技术评审指导原则》(征求意见稿)的意见。
该指导原则涵盖骨、关节、牙齿无源植入性医疗器械,关于产品性能:材料表征、陈品结构和机械性能、生物相容性、清洗灭菌以及动物试验和医工交互条件:增材制造软件设计、打印设备、工艺、后处理、原材料和终产品的测试,以及清洗、包装和灭菌等方面进行控制等进行规定。
四、3D打印医学相关企业名录
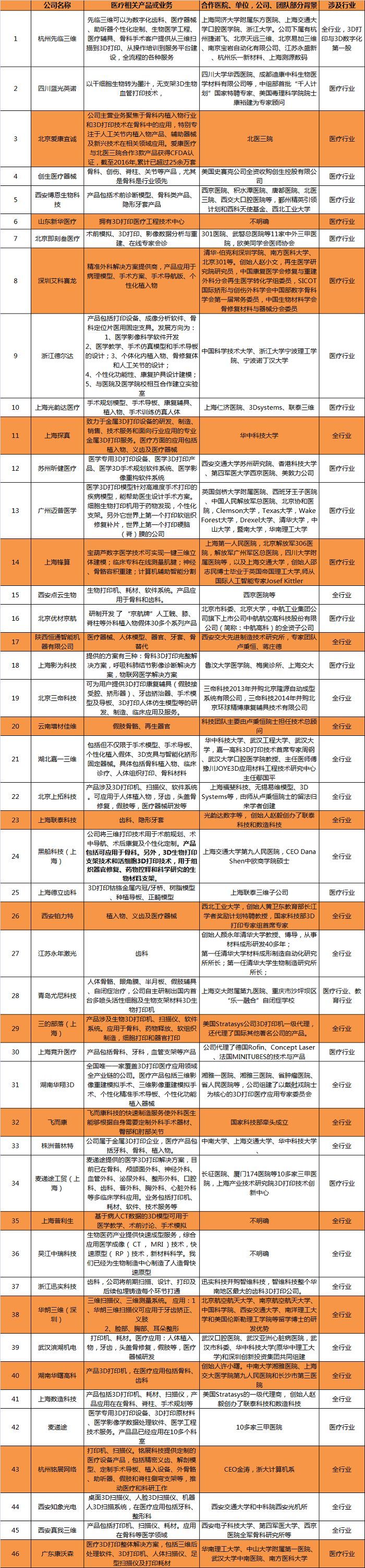
排名不分先后
图片来源:动脉网

